Mari kita mulai dengan 50 contoh perubahan kimia yang terjadi setiap saat, seringkali tanpa kita sadari. Dari makanan yang kita santap hingga proses vital dalam tubuh, dunia ini penuh dengan transformasi yang menakjubkan. Bayangkan betapa rumit dan menariknya dunia di sekitar, yang terus-menerus berubah di tingkat molekuler. Perubahan kimia adalah kunci untuk memahami bagaimana alam semesta ini bekerja.
Pembahasan ini akan membawa pada penjelajahan mendalam mengenai berbagai aspek perubahan kimia, mulai dari reaksi sehari-hari hingga dampak lingkungannya. Kita akan mengupas tuntas berbagai reaksi kimia, peran katalisator, serta bagaimana perubahan-perubahan ini memengaruhi kehidupan. Bersiaplah untuk terpesona oleh kompleksitas dan keindahan ilmu kimia!
Mengungkapkan Perubahan Kimiawi dalam Kehidupan Sehari-hari yang Sering Terabaikan

Source: z-dn.net
Kita seringkali terlalu fokus pada hal-hal besar dan gemerlap, lupa bahwa dunia di sekitar kita terus-menerus beroperasi melalui proses yang tak kasat mata. Perubahan kimiawi, transformasi yang mengubah zat menjadi substansi baru, adalah kekuatan pendorong di balik banyak aspek kehidupan kita, dari cara kita makan hingga cara alam bekerja. Memahami perubahan ini bukan hanya tentang ilmu pengetahuan; ini tentang menghargai kompleksitas dan keajaiban yang ada di sekitar kita setiap hari.
Perubahan Kimia dalam Kehidupan Sehari-hari: Lima Contoh Mendalam
Mari kita selami beberapa contoh perubahan kimia yang terjadi di sekitar kita, seringkali tanpa kita sadari. Setiap reaksi ini memiliki dampak yang signifikan, membentuk cara kita hidup dan berinteraksi dengan dunia.
- Memasak Makanan: Proses memasak adalah contoh klasik dari perubahan kimia. Ketika kita memanggang, merebus, atau menggoreng makanan, terjadi reaksi kimia yang mengubah struktur molekul makanan. Misalnya, protein dalam daging mengalami denaturasi dan koagulasi saat dipanaskan, mengubah tekstur dan rasa. Karbohidrat dalam nasi dan kentang mengalami karamelisasi, menghasilkan warna dan rasa yang khas. Reaksi Maillard, reaksi antara asam amino dan gula pereduksi, menciptakan aroma dan rasa yang kompleks pada makanan yang dimasak.
Mari kita mulai dengan sesuatu yang ringan: passing bawah adalah , teknik dasar dalam voli yang seringkali disepelekan, padahal fundamentalnya krusial! Jangan lupa, luangkan waktu untuk menikmati hiburan berkualitas, coba deh intip film rekomendasi 2021 , siapa tahu ada yang pas buat akhir pekanmu. Lalu, mari kita beralih ke sesuatu yang lebih mendalam: bagaimana ya teori persia masuknya islam ke indonesia bisa memberikan kita perspektif berbeda tentang sejarah?
Ingat, hidup ini tentang belajar dan beradaptasi, termasuk memahami contoh abstraksi dalam kehidupan sehari hari , yang membantu kita berpikir lebih luas dan kreatif.
- Pencernaan Makanan: Di dalam tubuh kita, pencernaan adalah serangkaian reaksi kimia yang kompleks. Enzim memecah makanan menjadi molekul yang lebih kecil yang dapat diserap oleh tubuh. Misalnya, amilase memecah pati menjadi glukosa, protease memecah protein menjadi asam amino, dan lipase memecah lemak menjadi asam lemak dan gliserol. Proses ini memungkinkan tubuh kita untuk mendapatkan energi dan nutrisi yang dibutuhkan untuk berfungsi.
- Pembakaran: Pembakaran bahan bakar, seperti kayu atau gas alam, adalah reaksi kimia yang menghasilkan panas dan cahaya. Dalam proses ini, bahan bakar bereaksi dengan oksigen, menghasilkan karbon dioksida dan air. Reaksi ini melepaskan energi dalam bentuk panas, yang dapat digunakan untuk berbagai keperluan, seperti memasak, memanaskan ruangan, atau menghasilkan listrik.
- Perkaratan: Perkaratan besi adalah contoh korosi, yaitu reaksi kimia antara besi dan oksigen di hadapan air atau kelembaban. Proses ini menghasilkan oksida besi, yang dikenal sebagai karat. Perkaratan melemahkan struktur besi dan dapat menyebabkan kerusakan yang signifikan pada bangunan, jembatan, dan infrastruktur lainnya.
- Pengisian Baterai: Baterai menyimpan energi melalui reaksi kimia. Ketika baterai digunakan, reaksi kimia menghasilkan arus listrik. Ketika baterai diisi ulang, reaksi kimia dibalik, mengembalikan bahan kimia ke keadaan semula dan menyimpan kembali energi. Proses ini memungkinkan kita untuk menggunakan perangkat elektronik portabel.
Membongkar Rahasia Reaksi Kimia yang Membentuk Dunia: 50 Contoh Perubahan Kimia

Source: bloglab.id
Dunia ini adalah panggung bagi jutaan reaksi kimia yang berlangsung setiap saat, dari skala mikroskopis hingga makroskopis. Reaksi-reaksi inilah yang membentuk, mengubah, dan menjaga kehidupan. Memahami mekanisme di balik perubahan kimiawi bukan hanya sekadar pengetahuan akademis; ini adalah kunci untuk membuka potensi tak terbatas yang tersembunyi dalam materi. Mari kita selami lebih dalam untuk mengungkap rahasia yang membentuk dunia kita.
Jenis-Jenis Reaksi Kimia Utama
Reaksi kimia hadir dalam berbagai bentuk, masing-masing dengan karakteristik unik dan peran penting dalam alam semesta. Mari kita bedah empat jenis reaksi kimia utama, memahami mekanismenya, dan melihat contoh-contohnya yang menakjubkan:
- Reaksi Pembakaran: Reaksi ini melibatkan reaksi cepat antara suatu zat dengan oksigen, menghasilkan panas dan cahaya. Contoh paling umum adalah pembakaran bahan bakar seperti kayu atau gas alam. Mekanismenya melibatkan pemutusan ikatan kimia dalam bahan bakar dan pembentukan ikatan baru dengan oksigen, melepaskan energi dalam bentuk panas dan cahaya. Contoh lainnya adalah pembakaran lilin, di mana lilin (hidrokarbon) bereaksi dengan oksigen di udara.
- Reaksi Netralisasi: Reaksi ini terjadi ketika asam bereaksi dengan basa, menghasilkan garam dan air. Proses ini menetralkan sifat asam dan basa dari reaktan. Contohnya adalah reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH), yang menghasilkan natrium klorida (NaCl, garam dapur) dan air (H₂O). Mekanismenya melibatkan transfer proton (ion hidrogen, H⁺) dari asam ke basa.
- Reaksi Pengendapan: Reaksi ini menghasilkan pembentukan padatan (endapan) dari larutan. Endapan terbentuk ketika dua atau lebih larutan bereaksi dan membentuk senyawa yang tidak larut. Contohnya adalah reaksi antara larutan timbal(II) nitrat dan kalium iodida, yang menghasilkan endapan timbal(II) iodida berwarna kuning. Mekanismenya melibatkan pembentukan ikatan ionik yang kuat antara ion-ion yang membentuk endapan.
- Reaksi Redoks (Reduksi-Oksidasi): Reaksi ini melibatkan transfer elektron antara dua zat. Oksidasi adalah hilangnya elektron, sedangkan reduksi adalah penerimaan elektron. Contohnya adalah perkaratan besi, di mana besi (Fe) teroksidasi menjadi ion besi(II) atau besi(III) oleh oksigen, sementara oksigen direduksi. Reaksi redoks sangat penting dalam berbagai proses, termasuk respirasi sel dan produksi energi listrik dalam baterai.
Proses Pembentukan Karat pada Besi
Perkaratan besi adalah contoh nyata dari reaksi kimia yang merusak, tetapi juga memberikan pelajaran berharga tentang bagaimana materi berinteraksi dengan lingkungannya. Berikut adalah deskripsi ilustratif tentang prosesnya:
Proses dimulai ketika besi (Fe) terpapar oksigen (O₂) dan air (H₂O). Air bertindak sebagai media yang memungkinkan ion-ion bergerak, dan oksigen adalah oksidator utama. Besi kehilangan elektron (teroksidasi) dan membentuk ion besi(II) (Fe²⁺). Elektron yang hilang ini berpindah melalui besi, menyebabkan reaksi redoks. Ion besi(II) kemudian bereaksi lebih lanjut dengan oksigen dan air untuk membentuk oksida besi terhidrasi, yang kita kenal sebagai karat (Fe₂O₃·xH₂O).
Setelah berolahraga, luangkan waktu untuk bersantai. Salah satu cara terbaik adalah dengan menonton film yang berkualitas. Jangan lewatkan daftar film rekomendasi 2021 yang akan membuat harimu lebih berwarna. Dengan begitu, pikiranmu akan lebih segar untuk menjelajahi pengetahuan baru, seperti sejarah penyebaran agama Islam di Indonesia.
Karat ini memiliki struktur yang keropos dan tidak melindungi besi di bawahnya, sehingga proses perkaratan terus berlanjut hingga seluruh besi terkorosi.
Menariknya, banyak teori yang berkembang, salah satunya adalah tentang teori persia masuknya islam ke indonesia. Mengetahui hal ini, kita jadi lebih menghargai keberagaman. Jadi, jangan ragu untuk terus belajar dan mengembangkan diri. Semua yang kita lakukan hari ini akan membentuk masa depan yang lebih baik, bukan?
Bayangkan permukaan besi yang awalnya halus, kemudian secara bertahap berubah menjadi lapisan cokelat kemerahan yang rapuh. Lapisan ini terus mengelupas, memperlihatkan besi di bawahnya yang kemudian juga mengalami korosi, menciptakan siklus kerusakan yang terus-menerus.
Reaksi Kimia yang Menghasilkan Perubahan Warna
Perubahan warna adalah indikator visual yang kuat dari terjadinya reaksi kimia. Mari kita lihat tiga contoh reaksi yang menghasilkan perubahan warna yang dramatis, beserta faktor-faktor yang memengaruhinya:
- Reaksi Iodin dengan Amilum: Ketika larutan iodin (I₂) ditambahkan ke larutan amilum (pati), terjadi perubahan warna menjadi biru kehitaman. Iodin berinteraksi dengan struktur heliks amilum, membentuk kompleks inklusi yang menyerap cahaya pada panjang gelombang tertentu, menghasilkan warna yang khas. Intensitas warna tergantung pada konsentrasi iodin dan amilum, serta suhu.
- Reaksi Pengendapan dengan Perubahan Warna: Seperti yang telah disebutkan sebelumnya, reaksi antara timbal(II) nitrat dan kalium iodida menghasilkan endapan timbal(II) iodida berwarna kuning. Perubahan warna terjadi karena pembentukan senyawa baru dengan sifat optik yang berbeda dari reaktan. Warna endapan juga dipengaruhi oleh ukuran partikel endapan dan konsentrasi reaktan.
- Reaksi Oksidasi-Reduksi dengan Perubahan Warna: Reaksi antara kalium permanganat (KMnO₄) dan asam oksalat (H₂C₂O₄) menghasilkan perubahan warna yang menarik. Kalium permanganat berwarna ungu, tetapi ketika bereaksi dengan asam oksalat, warna berubah secara bertahap menjadi tidak berwarna karena permanganat direduksi menjadi ion mangan(II) (Mn²⁺). Kecepatan perubahan warna dipengaruhi oleh suhu dan konsentrasi reaktan.
Kutipan dari Ilmuwan Terkemuka
“Pemahaman tentang perubahan kimia adalah fondasi dari semua ilmu pengetahuan. Tanpa itu, kita hanya akan melihat dunia sebagai tumpukan materi yang acak, bukan sebagai sistem yang dinamis dan saling terkait.”
Marie Curie
Kutipan Marie Curie ini sangat relevan. Pemahaman mendalam tentang perubahan kimia memungkinkan kita untuk memanipulasi materi, menciptakan teknologi baru, dan memecahkan masalah kompleks. Ilmu pengetahuan modern sangat bergantung pada kemampuan kita untuk memahami dan mengendalikan reaksi kimia.
Menyingkap Peran Katalisator dalam Mempercepat Perubahan Kimia
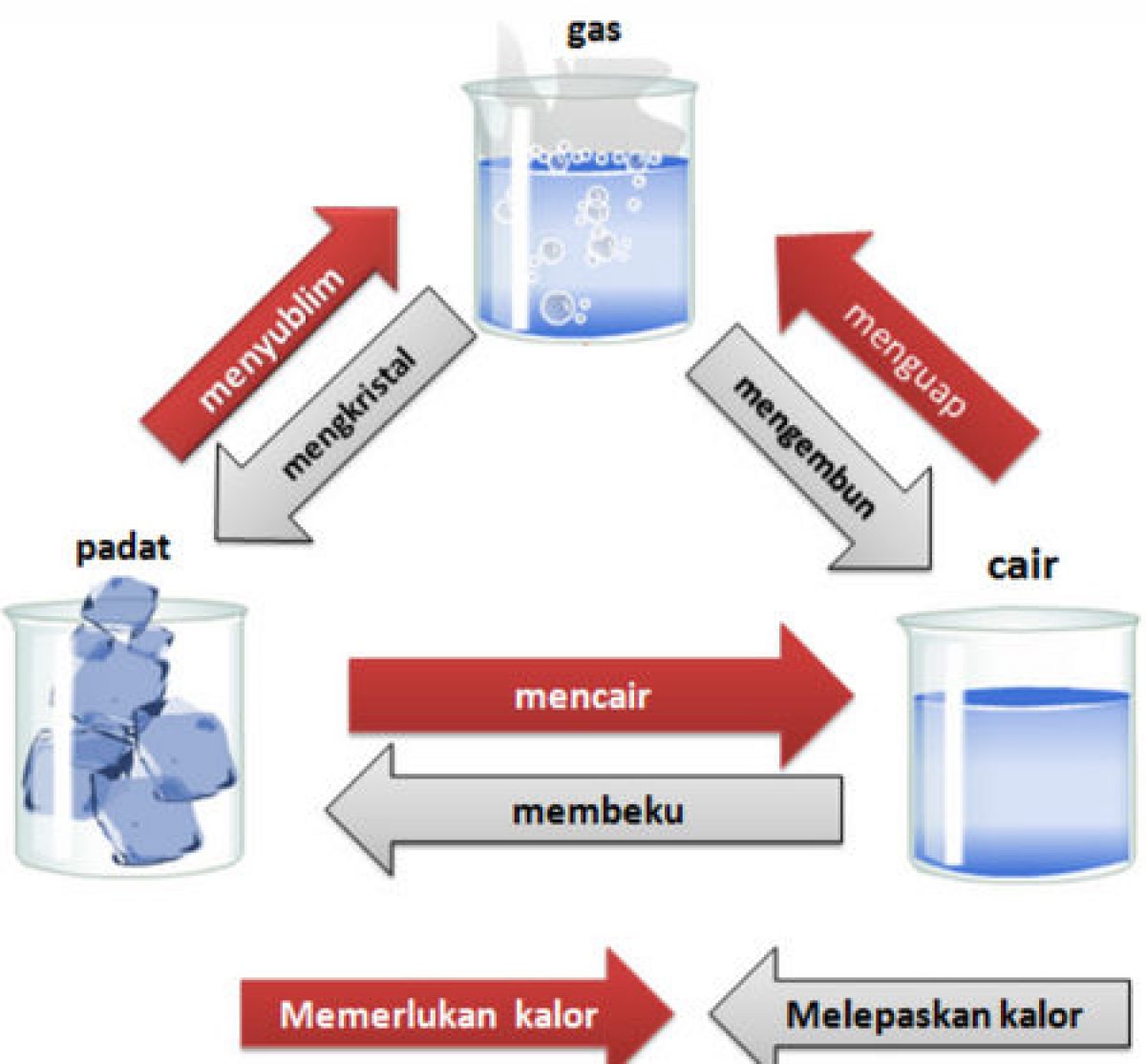
Source: rumushitung.com
Dunia ini penuh dengan perubahan kimia yang berlangsung setiap saat, dari pembakaran kayu hingga perkaratan besi. Namun, ada kalanya perubahan ini berjalan terlalu lambat, menghambat proses yang kita butuhkan. Di sinilah katalisator berperan, menjadi pahlawan tak terlihat yang mempercepat reaksi kimia, membuka jalan bagi inovasi dan efisiensi di berbagai bidang.
Memahami Katalisator dan Aksinya
Katalisator adalah zat yang mampu meningkatkan laju reaksi kimia tanpa dirinya sendiri mengalami perubahan permanen. Mereka bekerja dengan menyediakan jalur reaksi alternatif dengan energi aktivasi yang lebih rendah. Energi aktivasi adalah energi minimum yang dibutuhkan untuk memulai suatu reaksi. Dengan menurunkan energi aktivasi, katalisator memungkinkan reaksi berlangsung lebih cepat pada suhu yang sama. Bayangkan sebuah pendaki gunung yang ingin mencapai puncak.
Tanpa katalisator, pendaki harus mendaki jalur yang sangat curam (energi aktivasi tinggi). Dengan katalisator, pendaki dapat memilih jalur yang lebih landai (energi aktivasi rendah), sehingga lebih mudah mencapai puncak. Katalisator dapat berupa zat padat, cair, atau gas, dan mereka bekerja melalui berbagai mekanisme, seperti adsorpsi (penyerapan zat pada permukaan katalisator), pembentukan senyawa antara, atau orientasi molekul reaktan.
Dalam industri, katalisator memainkan peran krusial dalam berbagai proses. Tiga contoh penggunaan katalisator yang signifikan adalah:
- Produksi Amonia (Proses Haber-Bosch): Katalisator besi digunakan untuk menggabungkan nitrogen dan hidrogen menjadi amonia, yang merupakan bahan baku utama pupuk. Proses ini sangat penting untuk menyediakan makanan bagi miliaran orang di seluruh dunia. Tanpa katalisator, reaksi ini akan berjalan sangat lambat, membuatnya tidak ekonomis untuk produksi skala besar.
- Pembuatan Asam Sulfat (Proses Kontak): Vanadium pentoksida (V₂O₅) digunakan sebagai katalisator dalam proses kontak untuk mengoksidasi sulfur dioksida (SO₂) menjadi sulfur trioksida (SO₃), yang kemudian dilarutkan dalam air untuk menghasilkan asam sulfat. Asam sulfat adalah bahan kimia industri yang sangat penting, digunakan dalam produksi pupuk, deterjen, dan berbagai produk lainnya.
- Pemecahan Minyak Bumi (Cracking): Katalisator zeolit digunakan dalam proses cracking untuk memecah molekul hidrokarbon besar dalam minyak bumi menjadi molekul yang lebih kecil dan berguna, seperti bensin dan bahan bakar lainnya. Proses ini memungkinkan kita untuk mendapatkan lebih banyak produk yang berharga dari minyak mentah.
Pengaruh Suhu dan Konsentrasi terhadap Laju Reaksi
Suhu dan konsentrasi reaktan adalah dua faktor penting yang memengaruhi laju reaksi kimia. Kenaikan suhu umumnya meningkatkan laju reaksi. Hal ini karena peningkatan suhu memberikan energi kinetik yang lebih besar kepada molekul reaktan, menyebabkan mereka bergerak lebih cepat dan bertumbukan lebih sering dan lebih efektif. Sebagai contoh, memasak makanan pada suhu yang lebih tinggi mempercepat reaksi kimia yang bertanggung jawab atas perubahan rasa dan tekstur.
Bayangkan dua orang yang berlari menuju satu titik. Semakin cepat mereka berlari (suhu tinggi), semakin cepat mereka akan bertumbukan. Sebaliknya, penurunan suhu memperlambat laju reaksi. Reaksi yang terjadi dalam lemari es, misalnya, berjalan lebih lambat dibandingkan pada suhu ruangan, sehingga makanan lebih awet.
Konsentrasi reaktan juga memainkan peran penting. Semakin tinggi konsentrasi reaktan, semakin besar kemungkinan molekul reaktan bertumbukan dan bereaksi. Hal ini dapat dianalogikan dengan kerumunan orang di suatu ruangan. Semakin padat kerumunan (konsentrasi tinggi), semakin besar kemungkinan orang akan saling bertumbukan. Sebagai contoh, dalam industri, peningkatan konsentrasi reaktan sering digunakan untuk meningkatkan laju produksi.
Namun, penting untuk dicatat bahwa peningkatan konsentrasi tidak selalu meningkatkan laju reaksi secara linear. Terkadang, ada batas di mana peningkatan konsentrasi tidak lagi memberikan peningkatan yang signifikan dalam laju reaksi, karena faktor lain, seperti ketersediaan katalisator atau hambatan difusi, menjadi faktor pembatas.
Yuk, mulai hari ini dengan semangat baru! Pernahkah kamu terpikir, bagaimana kita bisa memproses informasi kompleks dengan mudah? Itu adalah contoh abstraksi dalam kehidupan sehari hari yang kita lakukan setiap saat. Lalu, jangan lupa untuk selalu menjaga kesehatan dengan olahraga ringan, seperti memahami teknik dasar passing bawah adalah dalam voli.
Reaksi Kimia yang Membutuhkan Katalisator
Beberapa reaksi kimia memerlukan katalisator agar dapat berlangsung pada laju yang praktis. Berikut adalah empat contoh reaksi tersebut:
- Oksidasi Sulfur Dioksida (SO₂) menjadi Sulfur Trioksida (SO₃): Seperti yang telah disebutkan sebelumnya, reaksi ini menggunakan katalisator vanadium pentoksida (V₂O₅) dalam proses pembuatan asam sulfat. Katalisator ini menyediakan permukaan untuk reaksi, menurunkan energi aktivasi, dan memungkinkan reaksi berlangsung lebih cepat pada suhu yang lebih rendah.
- Pembuatan Polietilena: Polietilena, plastik yang sangat umum, diproduksi melalui polimerisasi etilena. Katalisator, seperti katalis Ziegler-Natta atau katalis berbasis logam transisi, diperlukan untuk mengontrol proses polimerisasi dan menghasilkan polietilena dengan sifat yang diinginkan. Tanpa katalisator, reaksi polimerisasi akan berjalan sangat lambat atau bahkan tidak terjadi sama sekali.
- Pembentukan Amonia (N₂ + 3H₂ → 2NH₃): Proses Haber-Bosch, yang telah disebutkan sebelumnya, menggunakan katalisator besi untuk menggabungkan nitrogen dan hidrogen menjadi amonia. Katalisator ini sangat penting untuk meningkatkan laju reaksi karena nitrogen sangat stabil dan sulit untuk bereaksi.
- Penguraian Hidrogen Peroksida (H₂O₂): Hidrogen peroksida dapat terurai menjadi air dan oksigen. Reaksi ini dapat dipercepat dengan adanya katalisator, seperti kalium iodida (KI) atau enzim katalase yang ditemukan dalam sel. Katalisator ini menyediakan jalur reaksi alternatif dengan energi aktivasi yang lebih rendah, memungkinkan reaksi berlangsung lebih cepat.
Tips Praktis Mengontrol Laju Reaksi
Mengontrol laju reaksi kimia dapat dilakukan melalui beberapa cara. Berikut adalah lima tips praktis:
- Gunakan Katalisator: Memilih katalisator yang tepat dapat secara signifikan meningkatkan laju reaksi. Dalam memasak, misalnya, enzim dalam ragi digunakan untuk mempercepat fermentasi. Dalam industri, pemilihan katalisator yang efisien sangat penting untuk memaksimalkan produksi.
- Kontrol Suhu: Meningkatkan suhu biasanya meningkatkan laju reaksi, sementara menurunkan suhu memperlambatnya. Dalam memasak, suhu yang tepat diperlukan untuk mencapai hasil yang diinginkan, seperti memanggang kue. Dalam industri, suhu harus dikontrol dengan cermat untuk mengoptimalkan produksi dan mencegah reaksi yang tidak diinginkan.
- Atur Konsentrasi Reaktan: Meningkatkan konsentrasi reaktan umumnya meningkatkan laju reaksi. Dalam industri, konsentrasi reaktan seringkali disesuaikan untuk mengoptimalkan produksi.
- Gunakan Pengadukan atau Pencampuran: Pengadukan atau pencampuran reaktan membantu memastikan kontak yang lebih baik antara molekul reaktan, yang dapat meningkatkan laju reaksi. Dalam memasak, mengaduk adonan memastikan bahwa semua bahan tercampur dengan baik dan reaksi kimia berlangsung secara merata.
- Hindari atau Kontrol Inhibitor: Inhibitor adalah zat yang memperlambat laju reaksi. Dalam beberapa kasus, menghindari atau mengontrol keberadaan inhibitor dapat meningkatkan laju reaksi. Misalnya, dalam penyimpanan makanan, antioksidan digunakan untuk mencegah reaksi oksidasi yang menyebabkan kerusakan.
Mengeksplorasi Dampak Perubahan Kimia Terhadap Lingkungan dan Kehidupan

Source: tabbayun.com
Perubahan kimia, proses transformasi materi yang mengubah identitasnya, tak hanya terjadi di laboratorium. Ia hadir di setiap aspek kehidupan, dari proses alamiah hingga aktivitas manusia. Namun, di balik kemajuan yang dibawanya, terdapat pula dampak yang perlu kita cermati, terutama terhadap lingkungan dan kesehatan kita. Mari kita selami lebih dalam bagaimana perubahan kimia membentuk dunia di sekitar kita, baik dalam sisi positif maupun negatifnya.
Dampak Negatif Perubahan Kimia Terhadap Lingkungan
Perubahan kimia yang tak terkendali dapat memberikan dampak buruk bagi lingkungan. Beberapa contoh nyata menunjukkan betapa krusialnya kita memahami dan mengelola proses ini.
- Hujan Asam: Pembakaran bahan bakar fosil, seperti batu bara dan minyak bumi, melepaskan sulfur dioksida (SO2) dan nitrogen oksida (NOx) ke atmosfer. Gas-gas ini bereaksi dengan uap air dan oksigen, membentuk asam sulfat (H2SO4) dan asam nitrat (HNO3), yang kemudian jatuh ke bumi sebagai hujan asam. Dampaknya merusak hutan, mengasamkan danau dan sungai, serta merusak bangunan.
Solusi:
- Menggunakan teknologi scrubber pada cerobong asap industri untuk mengurangi emisi SO2 dan NOx.
- Beralih ke sumber energi terbarukan seperti tenaga surya dan angin.
- Mengurangi penggunaan kendaraan pribadi dan mendorong transportasi publik.
- Polusi Udara Akibat Pembakaran Bahan Bakar Fosil: Selain hujan asam, pembakaran bahan bakar fosil juga menghasilkan partikel-partikel halus (PM2.5 dan PM10) dan gas-gas berbahaya seperti karbon monoksida (CO) dan ozon (O3). Partikel-partikel ini dapat menyebabkan masalah pernapasan, penyakit jantung, dan bahkan kanker.Solusi:
- Meningkatkan standar emisi kendaraan.
- Menggunakan bahan bakar yang lebih bersih.
- Mengembangkan teknologi untuk menangkap dan menyimpan karbon dioksida (CCS).
- Pencemaran Air Akibat Limbah Industri: Industri seringkali membuang limbah kimia berbahaya ke sungai dan laut. Contohnya, logam berat seperti merkuri (Hg) dan timbal (Pb) dapat mencemari air dan meracuni ekosistem.Solusi:
- Menerapkan regulasi yang ketat terhadap pembuangan limbah industri.
- Mengembangkan teknologi pengolahan limbah yang efektif.
- Mendorong praktik industri yang lebih bersih dan berkelanjutan.
Peran Perubahan Kimia dalam Daur Ulang Limbah
Perubahan kimia memegang peranan penting dalam proses daur ulang limbah, mengubah material bekas menjadi bahan yang berguna kembali.
- Daur Ulang Plastik: Proses pirolisis, yaitu pemanasan plastik tanpa oksigen, memecah rantai polimer plastik menjadi monomer atau bahan bakar. Proses ini memungkinkan kita untuk mengurangi penumpukan limbah plastik dan menghasilkan bahan bakar alternatif. Contohnya, botol plastik PET dapat diubah menjadi serat poliester untuk pakaian atau botol baru. Prinsip dasarnya adalah dekomposisi termal yang mengubah struktur kimia plastik.
- Daur Ulang Kertas: Kertas bekas dilarutkan dalam air dan bahan kimia untuk memisahkan serat selulosa dari tinta dan kotoran. Serat-serat ini kemudian diolah kembali menjadi kertas baru. Proses ini melibatkan reaksi kimia untuk memisahkan dan membersihkan serat kertas.
- Pengomposan Limbah Organik: Limbah organik, seperti sisa makanan dan limbah pertanian, mengalami dekomposisi oleh mikroorganisme. Proses ini melibatkan reaksi kimia yang mengubah bahan organik menjadi kompos, yang dapat digunakan sebagai pupuk. Prinsip dasarnya adalah oksidasi dan dekomposisi bahan organik oleh bakteri dan jamur.
Dampak Perubahan Kimia pada Lingkungan dan Kesehatan Manusia
Berikut adalah tabel yang membandingkan dampak perubahan kimia pada lingkungan dan kesehatan manusia.
| Dampak pada Lingkungan | Contoh | Dampak pada Kesehatan Manusia | Contoh |
|---|---|---|---|
| Kerusakan Hutan | Hujan Asam | Gangguan Pernapasan | Paparan Polusi Udara (PM2.5) |
| Pencemaran Air | Limbah Industri Beracun (Merkuri, Timbal) | Keracunan | Konsumsi Air yang Tercemar Logam Berat |
| Perubahan Iklim | Emisi Gas Rumah Kaca (CO2 dari Pembakaran Fosil) | Penyakit Kardiovaskular | Paparan Polusi Udara (Ozon) |
Kisah Ilmuwan Berdedikasi, 50 contoh perubahan kimia
Dr. Anya Sharma, seorang ahli kimia lingkungan, mendedikasikan hidupnya untuk mencari solusi perubahan kimia yang berkelanjutan. Terinspirasi oleh keprihatinannya terhadap dampak polusi plastik, ia mengembangkan teknologi baru untuk mendaur ulang plastik dengan efisien. Ia menemukan proses katalitik yang mampu memecah plastik menjadi bahan mentah yang dapat digunakan kembali. Penemuannya, yang dikenal sebagai “Plastik Biru,” tidak hanya mengurangi limbah plastik secara signifikan, tetapi juga menciptakan lapangan kerja baru dalam industri daur ulang.
Teknologi ini kemudian diadopsi secara global, mengurangi pencemaran laut dan darat, serta memberikan harapan baru bagi planet ini. Dr. Sharma, yang awalnya hanya seorang ilmuwan di laboratorium, akhirnya menjadi pahlawan lingkungan yang menginspirasi generasi baru untuk peduli dan berinovasi demi masa depan yang lebih bersih dan sehat.
Penutupan Akhir

Source: kibrispdr.org
Memahami 50 contoh perubahan kimia bukan hanya tentang menghafal reaksi, tetapi tentang melihat dunia dengan cara yang baru. Setiap perubahan adalah peluang untuk belajar, berinovasi, dan berkontribusi pada masa depan yang lebih baik. Mari kita terus menggali dan merayakan keajaiban ilmu kimia, karena di dalamnya terdapat kunci untuk memahami alam semesta dan menciptakan dunia yang lebih berkelanjutan.